ПОДГРУППА VIIIB. ТРИАДЫ ЖЕЛЕЗА И ПЛАТИНОВЫХ МЕТАЛЛОВ
Индивидуальные триады VIIIB подгруппы имеют общий признак в том, что они занимают по одному положению в периодической таблице, что объясняется огромным сходством свойств элементов. Обозначение "B" для VIII группы не является необходимым, так как нет VIIIA подгруппы, однако химические и физические свойства элементов триад железа и платиновых металлов согласуются с общей классификацией их как переходных элементов.
ТРИАДА ЖЕЛЕЗА: ЖЕЛЕЗО, КОБАЛЬТ, НИКЕЛЬ
Тот факт, что члены триады железа более сходны друг с другом в своем переходном ряду, чем с элементами в столбцах периодической таблицы, не является необычным, так как во всех подгруппах первые члены подгруппы отличаются по своим свойствам. Температуры плавления элементов триады железа высокие, но ниже, чем у предшествующих элементов, находящихся в серединах серий переходных металлов. В табл. 15 приведены свойства, характеризующие сходство радиусов атомов, ионов и некоторых термических свойств.
Железо первый элемент в переходных рядах, имеющий спаренный электрон на внутренней d-орбитали. Спаренные электроны с такой орбитали труднее участвуют в образовании химической связи, чем неспаренные. Особенности внутреннего орбитального строения всех металлов этой триады проявляются в наличии у них сильных магнитных или ферромагнитных свойств. В магнитном поле атомы этих металлов ориентируются так, что металлы образуют постоянные магниты. Все металлы триады проявляют выраженное электроположительное поведение, металлическую связь, хорошую проводимость и металлический блеск. Они достаточно инертны в среде сильных окислителей и даже кислорода воздуха. В этих условиях на их поверхности образуются тонкие и инертные пленки оксидов, а также проявляется способность элемента предоставлять внутренние d-орбитали для образования связей с другими атомами по донорно-акцепторному механизму (например, от железа к хрому, вольфраму и другим металлам в процессах сплавления). Ни один элемент из триады железа не проявляет максимальной степени окисления VIII (в отличие от платиновых металлов). Все металлы триады железа образуют многообразные соединения, проявляя степени окисления II и III. Проявление высокой степени окисления и амфотерных свойств наиболее характерно для железа.
Железо. Железо второй (после алюминия) по распространенности металл, встречается в виде различных руд, пригодных для переработки (табл. 15). В США, например, богатая руда уже использована в сталелитейной промышленности. Железный рудник в районе Месаби-Рейндж (шт. Миннесота) теперь содержит только бедную железом гранитоподобную породу. Ее взрывают, извлекают, дробят и превращают в мелкий порошок. При обжиге образуется оксид железа, проявляющий магнитные свойства, благодаря чему из водной взвеси его отделяют от пустой породы магнитной сепарацией. Магнитный оксид брикетируют обкаткой в барабане, затем слегка спекают до получения окатышей, пригодных для доменного процесса. Таким способом из бедной руды (ЖЕЛЕЗА ТРИАДЫ И ПЛАТИНОВЫХ МЕТАЛЛОВ20% оксида железа) получают почти чистый Fe3O4, который совместно с известняком и коксом используется для выплавки чугуна в доменной печи.
Современная доменная печь это цилиндрическая башня высотой около 30 м и диаметром около 8 м. Через горн печи снизу вверх продувают подогретый воздух. Шихта в печи состоит из железной руды, известняка (CaCO3) и кокса. Подогретый воздух окисляет кокс c образованием СО и выделением тепла, которое вызывает плавление шихты, при этом силикаты переходят в CaSiO3, или шлам. Далее происходит ступенчатое восстановление оксида железа, разное в различных температурных зонах печи и зависящее от количества кислорода и концентрации СO. Получаемый чугун содержит только 93% Fe, остальное составляют C, Si, P и газовые включения азота, кислорода и других газов. Для удаления примесей C, S и P проводят обжиг в отражательных печах. Добавки определенных металлов сообщают сплаву твердость, вязкость, механическую прочность и другие физические свойства, необходимые для стали. Кроме того, полученный сплав обычно подвергают операциям отжига и закалки для создания хорошей кристаллической структуры и распределения фаз. Основная масса доменного чугуна передельный чугун (С > 4%) идет на переплавку в сталь в конвертерах, мартеновских или электрических дуговых печах; литейный чугун (С 2,43,8%) применяют в машиностроении для изготовления чугунного литья
(см. также ЖЕЛЕЗО; МЕТАЛЛЫ ЧЕРНЫЕ).
Кобальт. Металлический кобальт выделяют из руд, которые содержат много мышьяка, а также серебро в количестве, достаточном для промышленной переработки. Руду плавят с флюсом для получения сырого серебряного слитка, загрязненного штейна или сплава Co-As-Fe. Дополнительным обжигом удаляют As и Fe. Оставшиеся металлы, в том числе значительное количество меди, переводят в хлориды с помощью NaCl. Присутствующее серебро осаждают в виде AgCl. Водной вытяжкой в раствор переводят соли Co и Ni, которые затем осаждают в виде гидроксидов. Кобальт и никель очень похожи по химическим свойствам, поэтому их трудно отделить друг от друга. Разделение достигается благодаря тому, что Ni легко образует карбонил из NiO и CO, а кобальт нет. CoO восстанавливают до металла алюминием.
Никель. Никелевая руда в основном содержит смесь сульфидов никеля, меди и железа. При обжиге с дутьем воздуха и с песком в качестве флюса образуется смесь NiO и NiS. Большая часть железа переходит в шлак в виде силиката железа. При плавлении NiO-NiS в шахтной печи получают сплав Ni-Cu (штейн, который все еще содержит много серы). Штейн прокаливают в конвертере Бессемера, увеличивая содержание сплава Ni-Cu до 80%. Такой состав, все еще содержащий 20% серы, пригоден для использования в металлургии. Из этого сплава получают монель-металл, сплав, содержащий 70% Ni c добавками Cu, Fe и Mn. Чистые металлы можно получать из штейна комплексной переработкой, включая образование сульфидов в расплаве при добавлении Na2S. При этом NiS осаждается из расплава, а сульфиды меди и железа остаются в жидкой фазе. Полученный NiS после прокаливания образует NiO, из которого при восстановлении углеродом получают металл. Для получения металла высокой чистоты его растворяют и выделяют вновь электролитически. При этом среди прочих примесей на никелевом электроде осаждаются и платиновые металлы, которые с анода переходят в раствор при электролизе. Известен также карбонильный метод очистки никеля (Монд-процесс), при котором никель окисляют до оксида, затем получают летучий карбонил Ni(CO)4, при разложении которого образуется высокочистый никель.
Около половины получаемого никеля расходуется в производстве стали для повышения ее коррозионной стойкости и твердости. Он используется также для создания прочных покрытий на стальных изделиях; хотя хромовые покрытия предпочтительнее, лучшие результаты получаются при нанесении их на никелевую основу. Никелевый сплав пермаллой (78% Ni и 21% Fe) обладает высокой магнитной проницаемостью, что делает его ценным для использования в радиотехнике и системах связи. Американский "никель" пятицентовая монета состоит из сплава 25% Ni и 75% Cu, а "немецкое серебро" (нейзильбер) это сплав Ni-Zn-Cu с соотношением 1:1:2; высококоррозионностойкий сплав, используемый для изготовления термопар и обмотки катушек, состоящий из 74% Ni, 12% Fe, 11% Cr и 2% Mn, называется нихромом. Мелкодисперсный никелевый порошок применяется как эффективный катализатор гидрогенизации (например, конверсии масел в жиры).
Реакции. Все металлы триады железа реагируют с кислородом только при нагревании. Оксиды в низшей степени окисления имеют состав MO. Однако железо не образует оксид такого стехиометрического состава. В структуре оксида железа имеется дефицит железа и оксид отвечает формуле Fe0,95O, являясь нестехиометрическим соединением. При окислении Fe0,95O происходит окисление Fe2+ в Fe3+ с образованием Fe2O3. При этом обычно образуется оксид промежуточного состава Fe3O4. При добавлении щелочи к раствору соединений Fe2+ выпадает белый осадок Fe(OH)2, который быстро окрашивается в результате окисления и образования красного гидроксида железа(III) Fe(OH)3. При нагревании в восстановительной среде Fe(OH)2 выделяет оксид состава, близкого к FeO, который легко возгорается на воздухе. Кобальт и никель образуют оксиды строго стехиометрического состава CoO и NiO. В отличие от никеля, при добавлении к раствору Co2+ щелочи образуется светлоголубой Co(OH)2, быстро меняющий окраску на розовую и окисляющийся до состояния гидратированного оксида кобальта(III). При прокаливании CoO образуется Co3O4. Оксиды никеля и кобальта (NiO и CoO) получаются при разложении карбонатов NiCO3 и CoCO3. Соединения Co(III) окисляют воду с выделением кислорода. Гидратированный диоксид никеля NiO2*xH2O, получаемый электролитическим окислением NiO или Ni(OH)2, применяют в технологии аккумуляторов он служит катодом в никель-кадмиевых батареях ("никад", или NiO2-Cd), а также в железо-никелевом аккумуляторе Эдисона. Железо не образует оксидов со степенью окисления больше 3, но Fe(OH)3 или Fe2O3 можно окислить мощными окислителями в щелочной среде с образованием оксоанионов, что иллюстрирует амфотерный характер железа. Из гидроксида Fe(III) действием хлора в среде NaOH получают феррат(VI)-ион (FeVIO4)2, а из [[Fe(OH)6]]3 действием кислорода в присутствии Ba(OH)2 получают феррат(IV)-ион (FeIVO3)2, и наконец, феррат(V)-ион (FeVO4)3образуется из соединений Fe(II) под действием KO2. Соединения Fe(V) необычны для железа. Известен феррат(III)-ион FeIIIO2, образующийся из Fe2O3 и щелочи при высокой температуре; очевидно, что Fe(III) не проявляет ярко выраженной амфотерности.
Галогениды. Галогениды всех металлов триады железа образуются при непосредственном взаимодействии металлов с галогенами. Железо образует тригалогениды FeF3, FeCl3 и FeBr3, но не FeI3, так как иодид-ион окисляется железом(III) до свободного иода. FeCl3 существует в виде димера Fe2Cl6 (даже при 750° С в парах мало молекул мономера FeCl3), в чем он сходен с Al2Cl6. Кобальт со фтором образует CoF2 и CoF3, причем трифторид хороший фторирующий агент. Дигалогениды всех металлов триады и тригалогениды железа легко образуют комплексные соединения, как и следовало ожидать для переходных металлов. FeF3, например, образует комплексные ионы FeF52и FeF63. Cродство Fe(III) к OHпроявляется в гидролизе с образованием основных солей Fe(OH)Cl2 и Fe(OH)2Cl. Кобальт(III) слишком сильный окислитель, чтобы образовывать простые галогениды, хотя известны CoF3 и некоторые твердые соли Co(III), например Co2(SO4)3.
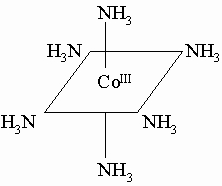
Комплексообразование. Состояние Co(III) можно стабилизировать в виде комплексного иона с помощью молекул или ионов, являющихся донорами электронной пары. Количество комплексных соединений Co(III) огромно и уступает, вероятно, только соединениям хрома. Донорами электронов или лигандами могут быть галогениды, аммиак, амины, диамины (например, этилендиамин NH2CH2CH2NH2), цианиды, органические кислоты, альдегиды, кетоны и многие другие соединения. Железо образует с цианид-ионом и ионом K+ темносиние комплексные ионы, например берлинскую лазурь Kfe[[Fe(CN)6]]. Другим важным комплексным соединением железа является нитропруссид натрия, красная соль состава Na2[[Fe(CN)5NO]]*2H2O, один из редких примеров положительно заряженного лиганда в комплексе: NO+ связан с Fe. Большой интерес для химиков представляет ферроцен Fe(C5H5)2 комплексное соединение Fe(II) c органической молекулой С5H6 (циклопентадиен) в качестве лиганда, имеющее структуру из двух органических молекул, между плоскостями которых находится железо. Такие соединения называются сандвичевыми. Аналогичные соединения образуют Co (кобальтоцен) и Ni (никелоцен).
Карбонилы. Наиболее необычный класс соединений представляют карбонилы, в которых переходный металл с координированными карбонильными группами образует связь с ионом металла или водорода. Пентакарбонил кобальта [[Co(CO)5]] образует натриевую соль Na[[Co(CO)5]], в которой степень окисления кобальта равна I, так как степень окисления CO равна 0. Другие необычные соединения известны для Ni, например, K2[[NiI(CN)3]], K4[[Ni0(CN)4]]. В соединении H2[[Fe(CO)4]] степень окисления железа равна II.
Сульфиды. Сульфиды FeS, CoS и NiS встречаются в составе природных руд. Их получают осаждением сероводородом из растворов солей M(II). FeS можно получить также прямым синтезом из металла и серы при нагревании, а также взаимодействием сероводорода с Fe2S3 при высоких температурах (7501000° С) в атмосфере H2.
Стереохимия. Соединения металлов триады железа отличаются разнообразием строения. Двухвалентные Ni(II) и Co(II) могут образовывать ионы со структурой типа плоского квадрата, тетраэдра или октаэдра; комплексные соединения Co(III) и Fe(III), как правило, содержат по 6 лигандов и имеют октаэдрические ионы, например